تشخیص اسید و باز یکی از مهمترین مباحث در شیمی است که در علوم مختلف، از جمله شیمی، زیستشناسی و داروسازی، کاربردهای فراوانی دارد. جالب است بدانید که اغلب خوراکیهایی که ما روزانه مورد استفاده قرار میدهیم خاصیت بازی یا اسیدی دارند.
از جهت دیگر، تشخیص اسید و باز میتواند نه تنها در علوم مختلف، بلکه در کارهای ساده روزانه نیز ضروری باشد. به همین جهت شیوههای بسیاری برای تشخیص این دو وجود دارند که برخی از آنها از زمانهای قدیم نیز مورد استفاده قرار میگرفتند.
استفاده از روشهای قدیمی میتواند در برخی مواقع کارآمد باشد. با اینحال مشخص است که روشهای مدرن نهتنها نتیجه دقیقتری را ارائه میدهند؛ بلکه در بسیاری موارد تنها شیوه مور اعتماد برای تشخیص اسید و باز از یکدیگر هستند.
اصلیترین شیوه تشخیص باز و اسید سنجش pH آنهاست که در واقع شاخص میزان اسیدی یا بازی بودن محلول مورد نظر میباشد که از 14 درجه تشکیل شده است. اما برای تشخیص بهتر اسید و باز، بهتر است در ابتدا توضیحی کلی از این دو ارائه داد.
اسید چیست؟
در ابتدا باید گفت که شاخص pH اسیدها کمتر از 7 است و هر چه میزان اسیدی بودن یک محلول بالاتر باشد این عدد کمتر میشود. از جمله ویژگیهای اصلی اسیدها ترشمزه بودن آن هاست. مواد خوراکی همچون مرکبات، گوجه و سرکه همگی خاصیت اسیدی دارند.
اسیدها به دلیل خاصیت خورندگی میتوانند روی سطح پوست احساس سوزش ایجاد کنند. در واقع همین ویژگی خورندگی است که موجب میشود اسیدهای قوی توانایی حل کردن برخی فلزات را دارا بوده و در لایهبرداری از سطوح فلزی به کار گرفته شوند.
فرمول شیمیایی اسیدها با یک یا دو اتم هیدروژن آغاز میشود. دلیل این مسئله این است که در زمان واکنش با آب اسید پروتون یا یون هیدروژن (H+) آزاد کرده و در عوض الکترون دریافت میکند. گفتنی است که این ویژگی باعث میشود محلولهای حاوی اسید از نظر الکتریکی رسانا باشند.
روش اصلی طبقهبندی اسیدها سنجش قابلیت آنها در تفکیک یون در آب است. بر این اساس، اسید به دو نوع قوی و ضعیف تقسیم میشود. اسیدهای قوی گروهی هستند که میتوانند به طور کامل در آب تفکیک یون انجام دهند و شامل نمونههایی مانند نیتریک، سولفوریک و هیدروبرومیک اسید میشوند.
در مقابل اسیدهای ضعیف قرار دارند که مشخصا توانایی تفکیک کامل یون در آب را ندارند و شامل نمونههایی همچون بوریک، کربنیک، هیدروسیانیک و فسفریک اسید میشوند.
باز چیست؟
مواد بازی یا قلیایی به طور کلی شاخص pH بیشتر از 7 دارند و هر چه میزان خاصیت قلیایی یک محلول بالاتر باشد این عدد بیشتر میشود. از جمله ویژگیهای اصلی بازها تلخمزگی و لغزندگی بالای آنهاست. از بازها به وفور در انواع صابونها، مواد شوینده و سفیدکنندهها استفاده میشود.
فرمول شیمیایی بازها با یک یا چند گروه هیدروکسید به پایان میرسد؛ چرا که مواد قلیایی در زمان واکنش با آب الکترون یا یون OH- آزاد کرده و در عوض پروتون دریافت میکنند. به همین دلیل است که بازها خاصیت خنثیسازی اسیدها را دارند.
جالب است بدانید که همانند اسید، مواد قلیایی نیز در صورت قوی بودن خاصیت خورندگی بالایی داشته و در صورت ترکیب با مواد اسیدی واکنش شدیدی نشان میدهند. در بین مواد قلیایی، برخی از آنها از جمله سدیم و کلسیم و آمونیوم هیدروکسید کاربرد بیشتری در زندگی انسان دارند.
برای مثال از سدیم هیدروکسید در تولید کاغذ و صابون، از آمونیوم هیدروکسید در تولید مواد شوینده و لکهبر و از کلسیم هیدروکسید در تولید انواع پودرهای سفیدکننده استفاده میشود.
روشهای تشخیص اسید و باز
ویژگیهای فیزیکی
از ابتداییترین شیوهها برای تشخیص اسیدی یا بازی بودن یک ماده سنجش ویژگیهای فیزیکی آن است. این روش هر چند در بسیاری موراد مورد اطمینان یا امن نیست؛ اما به دلیل وجود برخی ویژگیهای بارز در اسیدها و بازها میتواند به تشخیص آنها کمک کنند. به عنوان مثال:
- طعم: بسیاری از اسیدها طعم ترش دارند (مانند سرکه که حاوی اسید استیک است) در حالی که بازها معمولاً طعم تلخ دارند (مانند صابون).
- حالت فیزیکی: عمده اسیدها مایعاتی هستند که دارای بوی تند و خاص میباشند؛ در حالی که بسیاری از بازها جامداتی هستند که در آب حل میشوند.
استفاده از شناساگرهای طبیعی و مصنوعی
- شناساگرهای طبیعی
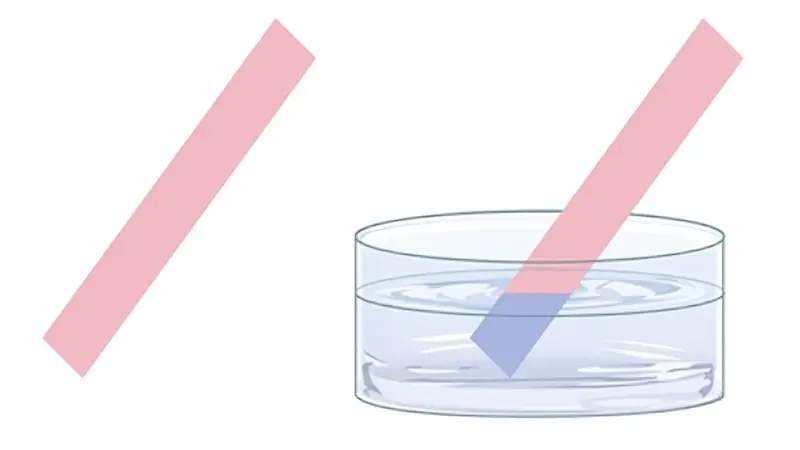
از جمله قدیمیترین روشها برای تشخیص باز و اسید، استفاده از شناساگرهای طبیعی مانند گلبرگهای گیلاس، توتسیاه، گل اطلسی و گل شمعدانی است.
این گلبرگها به دلیل وجود مادهای به نام آنتوسیانین میتوانند در تشخیص بازی یا اسیدی بودن مواد کمک کنند؛ بدین گونه که واکنش آنتوسیانین با مواد اسیدی باعث تغییر رنگ گلبرگ به قرمز و واکنش آن با مواد قلیایی موجب تغییر رنگ به بنفش یا آبی میشود.
- شناساگرهای مصنوعی
شناساگرهای مصنوعی به طور کلی میتوانند جوابی بسیار دقیقتر از نمونههای طبیعی ارائه بدهند؛ هرچند باید در نظر داشت که در مقایسه با دستگاهpH دقت و کارایی کمتری دارند. از جمله شناساگرهای مصنوعی میتوان به کاغذ تورنسل یا لیتموس اشاره کرد.
https://www.kepsico.com/litmus-paper/
کاغذ تورنسل یک نوع کاغذ است که به عنوان یک شاخص pH برای تشخیص اسیدها و بازها استفاده میشود. این کاغذ معمولاً از الیاف کاغذی تهیه شده و با عصاره گیاهان خاصی رنگآمیزی شده است که به آن خاصیت تغییر رنگ در محیطهای مختلف pH را میدهد.
کاغذهای تورنسل، در زمان استفاده از اسید به رنگ قرمز متمایل شده و در زمان استفاده از باز نیز به رنگ آبی تغییر رنگ میدهند. در صورت خنثی بودن محلول مورد استفاده نیز کاغذ معمولا تغییر رنگ نداده یا به رنگ بنفش در میآید.
استفاده از pH متر
استفاده از pH متر یکی از دقیق ترین روشها برای اندازهگیری pH محلول است. pH متر یک دستگاه الکترونیکی است که با استفاده از الکترودهای خاص، مقدار pH محلول را اندازهگیری میکند. این روش دقت بیشتری نسبت به استفاده از شاخصهای رنگی دارد و میتواند میزان اسیدیته یا قلیایی بودن محلول را به اندازه دقیقتری ارائه دهد.
واکنشهای شیمیایی
بسیاری از مواد شیمیایی خاصیت واکنشپذیری با اسیدها و بازها دارند. به عنوان مثال، اگر یک ماده قلیایی با یک اسید واکنش دهد، معمولاً نمک و آب تولید میشود. این واکنشها میتوانند به عنوان یک روش تشخیص استفاده شوند. به عنوان مثال:
- واکنش بیکربنات سدیم با اسید: اگر بیکربنات سدیم را به یک محلول اسیدی اضافه کنیم، حبابهای گاز دیاکسید کربن تولید میشود که نشاندهنده وجود اسید است.
- واکنش اسید با فلزات: بسیاری از فلزات مانند روی و آهن با اسیدها واکنش نشان میدهند و هیدروژن گاز تولید میکنند.
سخن پایانی
تشخیص اسید و باز یکی از مهارتهای پایه در شیمی است که با استفاده از روشهای مختلفی مانند استفاده از شاخصهای pH، استفاده از شناساگرها، واکنشهای شیمیایی و ویژگیهای فیزیکی امکانپذیر است. این تشخیص نه تنها برای دانشآموزان و دانشجویان شیمی مهم است؛ بلکه در صنایع مختلف نیز کاربردهای فراوانی دارد. با آگاهی از روشهای مختلف تشخیص، میتوانیم به راحتی وجود اسید یا باز را در محلولها شناسایی کنیم و از آنها در زمینههای مختلف بهرهبرداری نماییم.
نواندیشان تابع قوانین جاری کشور جمهوری اسلامی ایران در زمینه حقوق مولفین و ناشرین است، چنانچه نسبت به محتوای این صفحه صاحب حق نشر هستید و درخواست حذف آن را دارد، خواهشمند است از طریق این لینک به ما اطلاع دهید.
 نواندیشان | بهترین سایت علمی آموزشی کشور
نواندیشان | بهترین سایت علمی آموزشی کشور